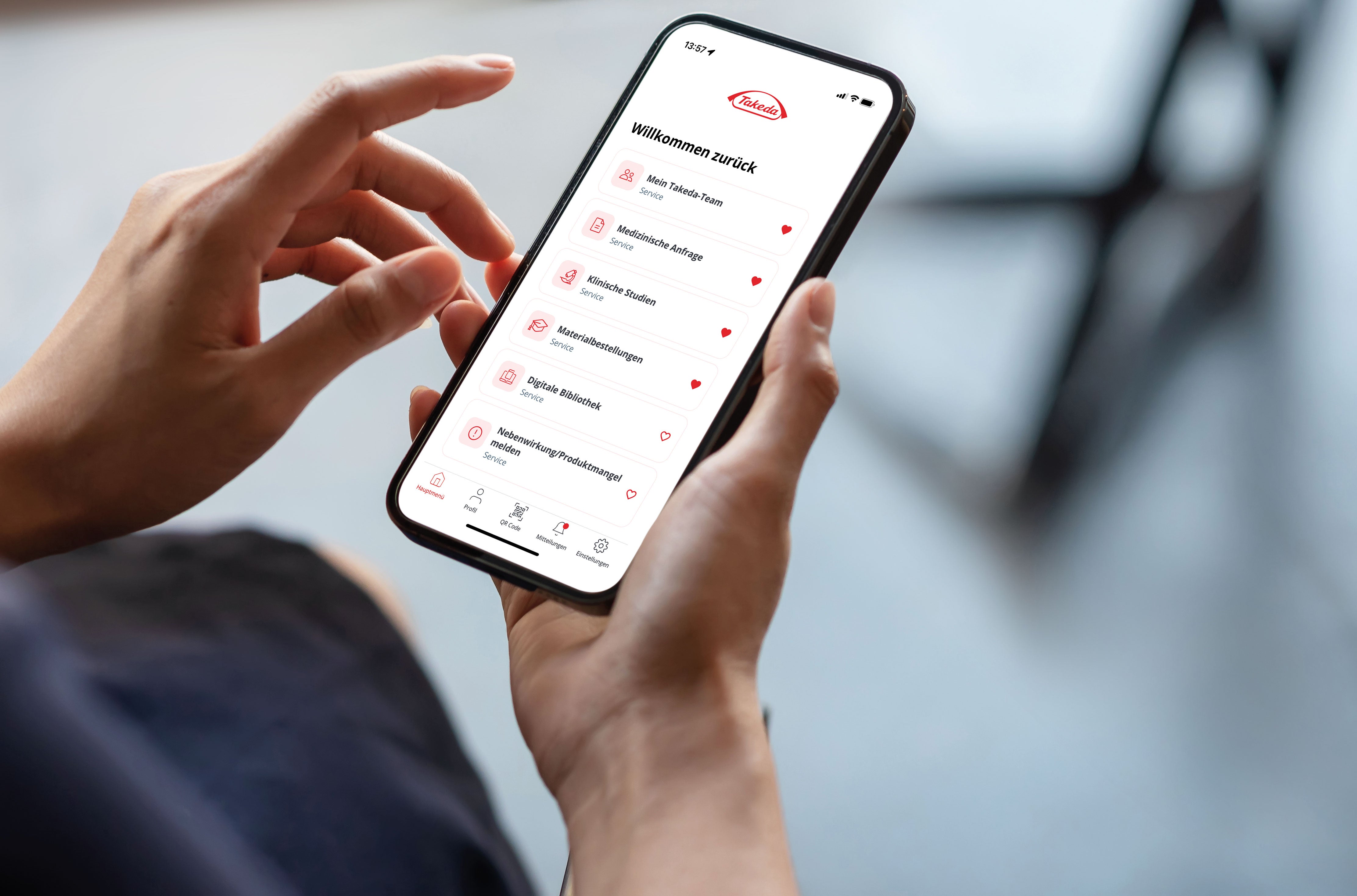
24/7 verfügbar
Diese Inhalte sind zum Teil geschützt und können nur von medizinischen Fachkreisen nach Heilmittelgewerbegesetz §10 eingesehen werden. Bitte melden Sie sich an oder erstellen Sie einen neuen Account.
Sie haben noch keinen Zugang?
- Ihr persönlicher Account - Direkter Kontakt, Medizinische Anfragen und Produktinformationen
- Weltweiter Zugang zu klinischen Takeda Studien
- Eventkalender und interessante Veranstaltungen
- Praxis- & Patientenmaterial Bestellungen, einfach, kostenios und indikationsübergreifend im Webshop
- Mit Ihrer Online-Bibliothek - Persönliche Dokumente und Links ablegen und jederzeit griffbereit behalten
- Nebenwirkungsmeidungen / Produktmangel schnell, einfach und Formular-gestützt melden